Tìm Việc Làm Ngành Dược & Y Tế
1335
Olaparib hiện đã được FDA chấp thuận sử dụng kết hợp với bevacizumab như một liệu pháp điều trị duy trì ở những bệnh nhân đáp ứng với hóa trị liệu đầu tay và mắc ung thư thuộc trường hợp thiếu hụt tái tổ hợp tương đồng, được xác định bởi một đột biến BRCA nguy hiểm hoặc nghi ngờ bất ổn hình thành gene.
FDA cũng đã phê duyệt test Myx myChoice CDx như một chẩn đoán sử dụng đồng hành với olaparib.
Kết quả thử nghiệm
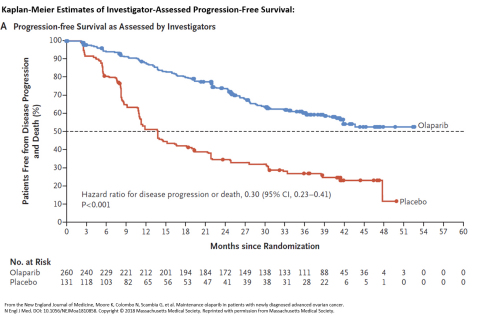
Hiệu quả của olaparib và test myxoice CDx được đánh giá ở những bệnh nhân trong pha 3 thử nghiệm PAOLA-1 (NCT02477644). Nghiên cứu ghi nhận bệnh nhân bị K buồng trứng biểu mô, ống dẫn trứng tiến triển, hoặc ung thư phúc mạc nguyên phát đã được hóa trị liệu theo phương án điều trị đầu tay và bevacizumab.
Bệnh nhân được phân tầng theo kết quả điều trị đầu tay và tình trạng đột biến BRCA. Tất cả các mẫu lâm sàng có sẵn đã được kiểm tra hồi cứu bằng xét nghiệm Myx myChoice CDx.
Các bệnh nhân được chọn ngẫu nhiên để được kê olaparib với liều 300 mg uống hai lần mỗi ngày, kết hợp với bevacizumab 15 mg / kg mỗi 3 tuần (n = 537) hoặc giả dược cộng với bevacizumab (n = 269). Bệnh nhân tiếp tục dùng bevacizumab trong chế độ duy trì và bắt đầu dùng olaparib 3-9 tuần sau liều hóa trị cuối cùng. Olaparib có thể được tiếp tục kê đến 2 năm hoặc cho đến khi bệnh tiến triển hoặc độc tính vượt mức.
Thời gian sống sót với tình trạng bệnh không tiến triển trung bình trong số 387 bệnh nhân có khối u nhận thấy sự thiếu tái tổ hợp tương đồng là 37,2 tháng ở nhóm dùng olaparib và 17,7 tháng ở nhóm dùng giả dược (tỷ lệ nguy cơ, 0,33).
Các tác dụng phụ nghiêm trọng xảy ra ở 31% bệnh nhân ở nhóm olaparib. Phổ biến nhất là tăng huyết áp (19%) và thiếu máu (17%).
Sự gián đoạn liều do các tác dụng phụ xảy ra ở 54% bệnh nhân ở nhóm olaparib và giảm liều do các tác dụng phụ xảy ra ở 41%.
DS Phương Thảo
Theo Medscape.
Tin liên quan
TALK 02: TIÊU CHUẨN CỦA TRỢ LÝ NHÃN HÀNG THÀNH CÔNG
18 - SepOctNovDec
TALK 01: QUẢN LÝ BÁN HÀNG KÊNH OTC
13 - SepOctNovDec