Tìm Việc Làm Ngành Dược & Y Tế
947
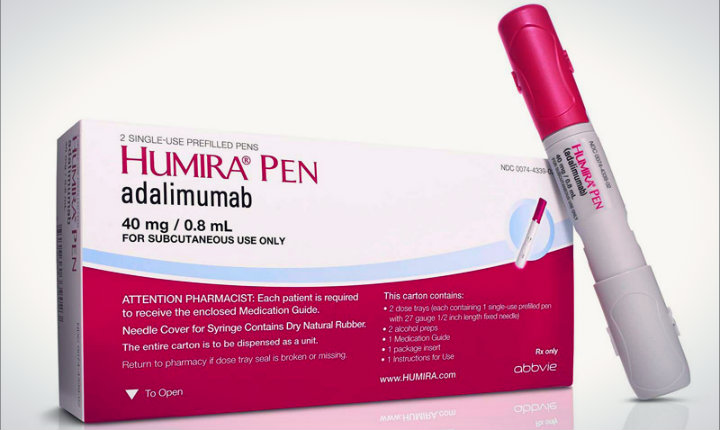
Abrilada, một sản phẩm tương đương sinh học (biosim) của thuốc vô cùng nổi tiếng: Humira của AbbVie, đã giành được sự chấp thuận của FDA hôm qua (18/11), trở thành sản phẩm tương đương sinh học thứ 25 nhận được đèn xanh từ cơ quan này. Và giống như nhiều sản phẩm đi trước trong nhóm, Abrilada sẽ phải mất một thời gian để ra mắt do liên quan đến vấn đề bằng sáng chế.
Pfizer vào tháng 11 năm ngoái đã ký một thỏa thuận bằng sáng chế với AbbVie để cho phép ra mắt năm 2023, cùng với các công ty khác thực hiện các thỏa thuận bằng sáng chế với AbbVie thay vì khởi kiện một mạng lưới bằng sáng chế phức tạp.

Abrilada giành được sự chấp thuận của FDA để điều trị các bệnh viêm khác nhau đã được điều trị bởi Humira. Công ty cho biết họ sẽ cung cấp thêm thông tin chi tiết về kế hoạch ra mắt tại thời điểm gần triển khai. Trong khi đó, công ty có ba lần ra mắt biosim được thiết lập trong vài tháng tới- CEO Albert Bourla thông báo trong một cuộc gọi hội nghị gần đây. Pfizer có kế hoạch tiếp nhận bộ ba thuốc Roche, ra mắt thuốc tương đương sinh học Avastin vào ngày 31 tháng 12, sau đó là thuốc sinh học Rituxan vào tháng 1 và thuốc sinh học Herceptin vào tháng 2 năm sau.
Theo các thỏa thuận bằng sáng chế hiện có của AbbVie, với các bản sao, Amgen sẽ có cơ hội ra mắt sản phẩm tương đương sinh học Humira đầu tiên tại Hoa Kỳ vào năm 2023.

Trong khi đó, các biosim với Humira đã thâm nhập vào châu Âu, đánh cắp thị phần và đẩy giá thấp hơn. AbbVie đã thu về gần 20 tỷ đô la doanh thu trên sản phẩm Humira vào năm ngoái và nhà sản xuất đã đồng ý mua Allergan để củng cố lại lợi nhuận trong tương lai của mình trước tình hình mất sự độc quyền tại Hoa Kỳ.
DS Phương Thảo.
Theo Fiercepharma
Tin liên quan
TALK 02: TIÊU CHUẨN CỦA TRỢ LÝ NHÃN HÀNG THÀNH CÔNG
18 - SepOctNovDec
TALK 01: QUẢN LÝ BÁN HÀNG KÊNH OTC
13 - SepOctNovDec