Tìm Việc Làm Ngành Dược & Y Tế
712

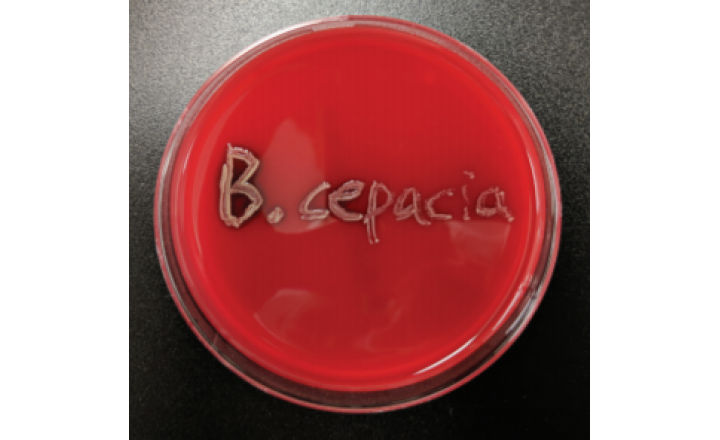
FDA đã gửi thư cảnh cáo hãng Dược phẩm Torrent sau khi hệ thống nước tại nhà máy của Torrent ở Levittown, Pennsylvania được xét nghiệm dương tính với vi khuẩn Burkholderia cepacia.
Trong một bức thư cảnh báo được đăng hôm thứ ba tuần này, FDA cho biết hệ thống nước tại nhà máy ở Levittown, Pennsylvania đã thử nghiệm dương tính với Burkholderia cepacia sau khi vi khuẩn được phát hiện trong các mẫu thiết bị sản xuất.
Tuy nhiên, phía nhà sản xuất lại đổ lỗi cho vấn đề phụ kiện kém của hệ thống và nói rằng họ sẽ thay thế phụ kiện, nhưng phía FDA cho biết hệ thống tạm thời mà phía nhà máy dự định sử dụng trong thời gian đó sẽ đáp ứng các tiêu chuẩn của FDA.
Ngoài ra, thư cảnh báo của FDA cho biết nhà sản xuất thuốc này đang bán một loại thuốc uống dạng dng dịch phenobarbital USP và thuốc đạn hydrocortisone acetate chưa được cơ quan này chấp thuận.
Torrent vào hồi tháng 8 đã thu hồi hàng chục sản phẩm dược phẩm OTC, bao gồm cả thuốc ho cho trẻ em và thuốc đạn dành cho người lớn và thuốc xịt mũi. Torrent không nhận được bất kỳ báo cáo nào về nhiễm khuẩn nhưng FDA cho biết công ty sẽ có thể cải thiện chất lượng tốt hơn khi có được một nhà tư vấn bên ngoài giúp họ nâng cấp hệ thống chất lượng.
Năm 2016, FDA cho rằng cho sự bùng phát của Burkholderia cepacia bắt nguồn từ hệ thống nước của CMO PharmaTech có trụ sở tại Florida. Trong tất cả, 60 người ở tám tiểu bang đã bị nhiễm bệnh, bao gồm cả bệnh nhân xơ nang thở máy sau khi họ được cho dùng thuốc táo bón do CMO sản xuất.
Đây là bức thư cảnh báo thứ hai được gửi cho Torrent trong vòng một tháng. Vào tháng 10, FDA cũng đã nhắc đến một nhà máy Torrent ở Ấn Độ là một trong những “nhân vật trung tâm” trong bê bối sản xuất thuốc điều trị huyết áp được phát hiện có chứa nồng độ NDMA và các chất gây ung thư khác. Phát hiện này đã dẫn đến việc thu hồi toàn cầu các thuốc ức chế thụ thể angiotensin II (ARB) như valsartan, losartan và irbesartan.

FDA cho biết Torrent là một trong những đối tượng của một cuộc điều tra toàn cầu đang diễn ra đối với vụ việc sản xuất thuốc bị nhiễm độc. Kể từ đó, FDA đã đề cập đến một nhà máy Mylan cho nhiều vấn đề tương tự.
DS Phương Thảo.
Theo Fiercepharma
Tin liên quan
TALK 02: TIÊU CHUẨN CỦA TRỢ LÝ NHÃN HÀNG THÀNH CÔNG
18 - SepOctNovDec
TALK 01: QUẢN LÝ BÁN HÀNG KÊNH OTC
13 - SepOctNovDec