Tìm Việc Làm Ngành Dược & Y Tế
774
Quốc vụ viện Trung quốc vừa tiết lộ dự thảo cải tổ thành phần chính phủ, trong đó CFDA – Cục quản lý Dược phẩm và thực phẩm Trung quốc sẽ sát nhập với tổng cục giám sát kiểm dịch và kiểm tra chất lượng, cơ quan quản lý quảng cáo, bảo vệ doanh nghiệp và người tiêu dùng và trở thành Uỷ ban giám sát thị trường quốc gia - State Administration for Market Supervision. Dự thảo này sẽ được phê duyệt vào đầu tháng 3.2019 trong phiên họp của Đại hội đại biểu nhân dân toàn quốc tức Quốc hội Trung quốc.
Trước đây việc đăng ký thuốc và thiết bị y tế phải thông qua Cục Thương mại và Công nghiệp, Cục Kiểm dịch, kiểm tra và Giám sát chất lượng chịu trách nhiệm quản lý chất lượng. Và sắp tới toàn bộ các cơ quan này sẽ được sáp nhập.
Cụ thể hơn, CFDA sẽ bỏ mảng thực phẩm và trở thành CDA – Cục quản lý dược Trung quốc. VĂn phòng CDA sẽ chỉ hoạt động ở cấp tỉnh. Các cấp thành phố sẽ bị huỷ bỏ.
Trung quốc là thị trường dược phẩm lớn thứ hai thế giới, đạt 126 tỷ USD năm 2017. Toàn Trung quốc có 5000 công ty dược phẩm và kỳ vọng giảm xuống 1000 sau năm 2024.
Có thể nói chính phủ Trung quốc đã quyết tâm thay đổi lớn toàn ngành y tế, dược phẩm để có thể dẫn đầu thế giới trong thời gian tới, cùng với việc gia nhập ICH, cải tổ lớn nội bộ và có vai trò quan trọng trong kế hoạch Made in China 2025 của Tập cận bình.
Các thay đổi lớn về chính sách dược phẩm Trung quốc.
- Chấp nhận dữ liệu lâm sàng thử nghiệm bên ngoài lãnh thổ Trung quốc, để quá trình phê duyệt thuốc mới nhanh hơn.
- Đơn giản hoá quy trình thử lâm sàng. Sau khi nộp đơn thử nghiệm và CDA và các tỉnh không đưa ra bất cứ vấn đề gì thì mặc nhiên được coi là chấp thuận và có thể tiến hành thử lâm sàng.
- Các công ty có thể chọn các đơn vị thử nghiệm ở giai đoạn phase I, kể cả tư nhân để thúc đẩy cạnh tranh và đầu tư từ phía các công ty tư nhân.
- Thúc đẩy phê duyệt nhanh hơn cho các thuốc và thiết bị đáp ứng các nhu cầu khẩn cấp hoặc bệnh hiếm gặp.
- Triển khai hệ thống MAH - Market Authorisation Holders. Theo hệ thống mới, các MAH sẽ chịu trách nhiệm nghiên cứu tiền lâm sàng, thử nghiệm lâm sàng, sản xuất, kiểm soát chất lượng nguyên liệu thô, phân phối và báo cáo các phản ứng có hại của thuốc. MAH sẽ chịu trách nhiệm hoàn toàn cho mọi trách nhiệm liên quan đến thuốc. MHA có thể là cá nhân hay tổ chức, giữ bản quyền marketing thuốc, được thuê các công ty gia công sản xuất.
Các trình dược viên của các hãng thuốc và thiết bị y tế sẽ bị cấm mọi công việc liên quan bán hang và phải đăng ký với CDA.
- Mọi thay đổi sau phê duyệt (PAC) phải được gửi trực tuyến và được đánh giá bởi trung tâm đánh giá thuốc CDE của CFDA thay vì các tỉnh như trước kia.
- Khái niệm “imported drug” đề cập đến các thuốc sản xuất ngoài Trung quốc nhưng được được bán tại đây và có thể được miễn phí kiểm nghiệm.
- CFDA sẽ chấm dứt việc cấp GMP. Việc tái cấp GMP 5 năm một lần sẽ chấm dứt và thay bằng kiểm tra thường xuyên dựa vào mức độ rủi ro sẽ được CFDA thiết lập.
Điểm lại các thay đổi của ngành dược và y tế Trung quốc từ trước đến nay
- 21/11/1949: thành lập bộ y tế Trung quốc.
- 1954: Khởi tạo kế hoạch RCMS - Chương trình y tế hợp tác xã nông thôn.
- 1978: Thành lập cục quản lý dược phẩm – PA thuộc bộ y tế. Cơ quan này hầu như không có vai trò gì trong kiểm soát chất lượng thuốc và hoàn toàn bị các nhà máy quốc doanh khống chế.
- 1984 Chương trình y tế hợp tác xã nông thôn sụp đổ sau đợt cải cách nông nghiệp bắt đầu năm 1980.
- Năm 1997, chính phủ Trung Quốc đưa ra quyết định cải cách phát triển các vấn đề vệ sinh dịch tễ. Chính sách cải cách phát triển của nước này đã nêu rõ: "Thực hiện Y – Dược phân ly để hạch toán, chia ra quản lý".
- 1998: thành lập Cục quản lý Dược nhà nước Trung quốc – SDA trực thuộc Quốc vụ viện.
- 1998: Thành lập CDC – trung tâm phòng chống và kiểm soát bệnh tật Trung quốc trực thuộc bộ y tế.
- 2002: khởi tạo Chương trình y tế hợp tác xã nông thôn mới – NRCMS. Đỉnh cao có hơn 90% dân số đã tham gia NRDMS.
- 2016: NRCMS sát nhập với URBMS - Chương trình y tế cơ bản cho cư dân đô thị thành một chương trình chung.
- 2003: SDA được thêm vào các chức năng về quản lý thực phẩm, mỹ phẩm, sản phẩm dinh dưỡng và trở thành SFDA.
- 7/2007: cục trưởng cục Quản lý dược SFDA Trịnh Tiêu Du bị xử tử sau bê bối cấp phép thuốc giả.
- 2007: Cục quản lý dược bị bộ y tế thâu tóm.
- 3/2008: thành lập Bộ An sinh xã hội và Nhân lực.
- 2009: Lần đầu ban hành danh mục thuốc thiết yếu – EDL gồm 307 loại thuốc được đàm phán giữa nhà nước và các công ty để bán độc quyền, với giá thấp nhất tại các cơ sở y tế. Trong khi đó các công ty dược đều đánh gía chương trình thuốc thiết yếu đã tác động tiêu cực tới hoạt động kinh doanh của họ.
- 2013: Cục quản lý dược độc lập khỏi bộ y tế và được giám sát trực tiếp bởi Quốc vụ viện tức Chính phủ Trung quốc – CFDA.
- 3/2013: Bộ Y tế cùng Ủy ban Dân số và Kế hoạch hóa gia đình đã sáp nhập lại thành Ủy ban Kế hoạch hóa Gia đình và Y tế quốc gia.
- 2016: thiết lập chương trình đảm bảo chất lượng thuốc generic đã được bán ngoài thị trường để đảm bảo tương đương điều trị.
- 2016: Triển khai thí điểm MHA. NGười giữ bản quyền marketing thuốc có thể là cá nhân hay tổ chức, được thuê các nhà máy gia công hàng.
- 2017: Yêu cầu các thuốc generic mới phải đạt tương đương sinh học.
- 6/2017: CFDA gia nhập ICH. Dự đoán sau 4 năm, số công ty dược phẩm giảm dưới 1000.
- 9/2017: Hình thành bản nháp Orange book.
- 3/2018: Giải thể Ủy ban Kế hoạch hóa Gia đình và Y tế quốc gia và thành lập Uỷ ban y tế quốc gia NHC.
- 29/8/2018: TRên trang web chính thức của CFDA đã thông báo tên tiếng Anh của CFDA đổi thành “National Medical Products Administration “NMPA” vì thế các đơn đăng ký visa mới trong tháng 9 có thể dùng form và tên mới.
BD 27/2/19.
Tin liên quan
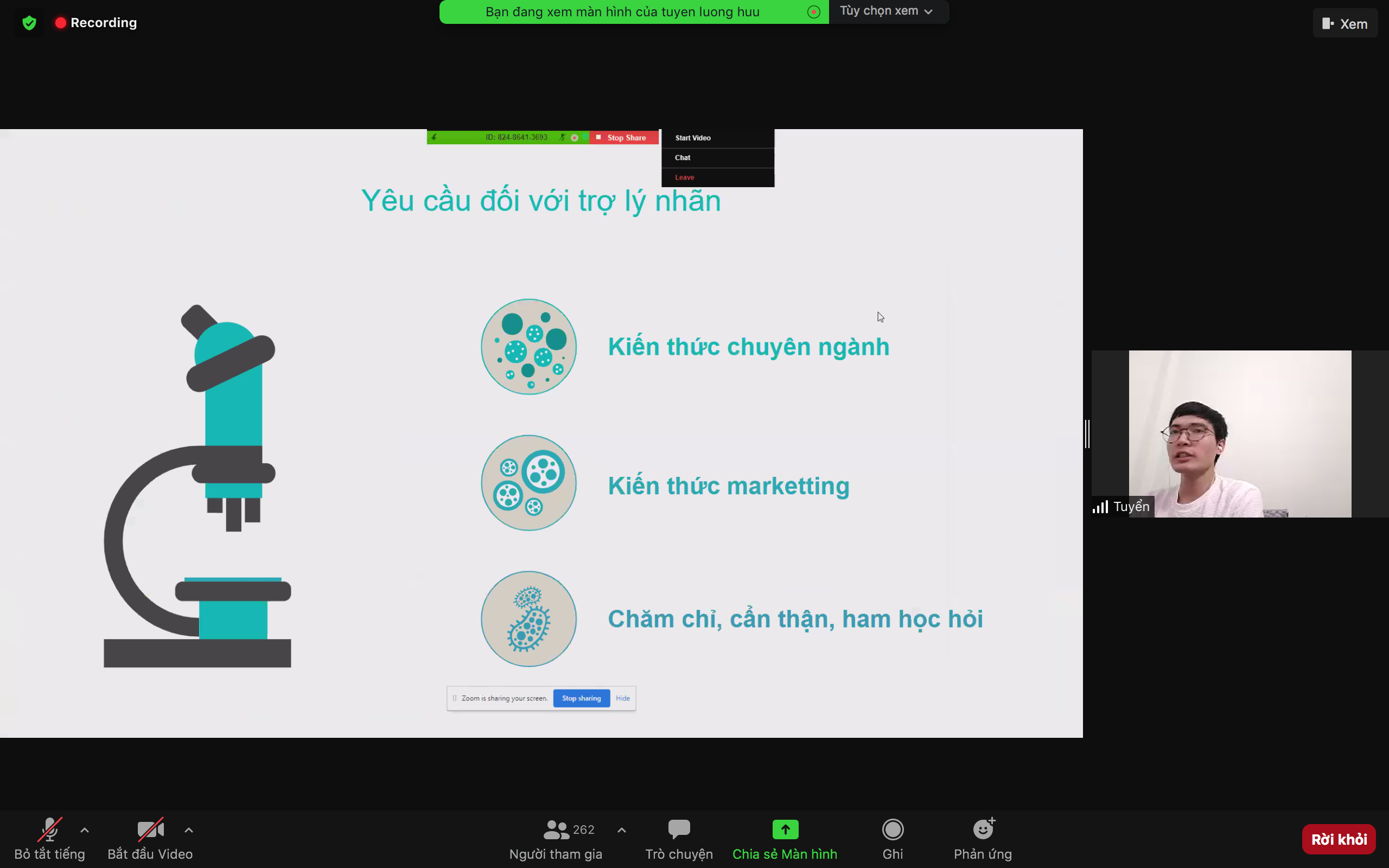
TALK 02: TIÊU CHUẨN CỦA TRỢ LÝ NHÃN HÀNG THÀNH CÔNG
18 - SepOctNovDec
TALK 01: QUẢN LÝ BÁN HÀNG KÊNH OTC
13 - SepOctNovDec